
人体に投与されて治療等に用いられるものとして医薬品がありますが、これとは別のカテゴリに位置付けられるものに「再生医療等製品」というものがあります。従来の医薬品では難しかった病気の治療に期待されているものです。
今回は、この「再生医療等製品」の概要について見てみましょう。
「再生医療」と聞いて、まず思い起こされることは、「失われた身体の組織や臓器等を再生して本来の生体機能を再建する治療」ということではないでしょうか。これだと何となく外科的な治療のイメージになりそうですが、「再生医療等製品」というのはもう少し範囲が広く、医薬品と同様の役割を持つ細胞や遺伝子といった形態の異なるものを含めて、医薬品医療機器等法では別のカテゴリとして定義されています。
「再生医療等製品」とは、生きた細胞や組織を加工(培養、活性化、分化誘導等)して作成されたもので、医薬品医療機器等法では以下のような定義となっています。
> 人または動物の細胞に培養等の加工を施したもの
- 身体の構造・機能の再建・修復・形成するもの ・・再生医療製品
- 疾病の治療・予防を目的として使用するもの ・・細胞治療製品
> 疾病の治療を目的として、人または動物の細胞に導入され、体内で発現する遺伝子を含有させたもの ・・遺伝子治療製品
実際には、上記の3分類(再生医療製品・細胞治療製品・遺伝子治療製品)は独立の分類ではなく、およそ下図に示すような関係となっています。(但し、この関係も絶対的なものではありません)
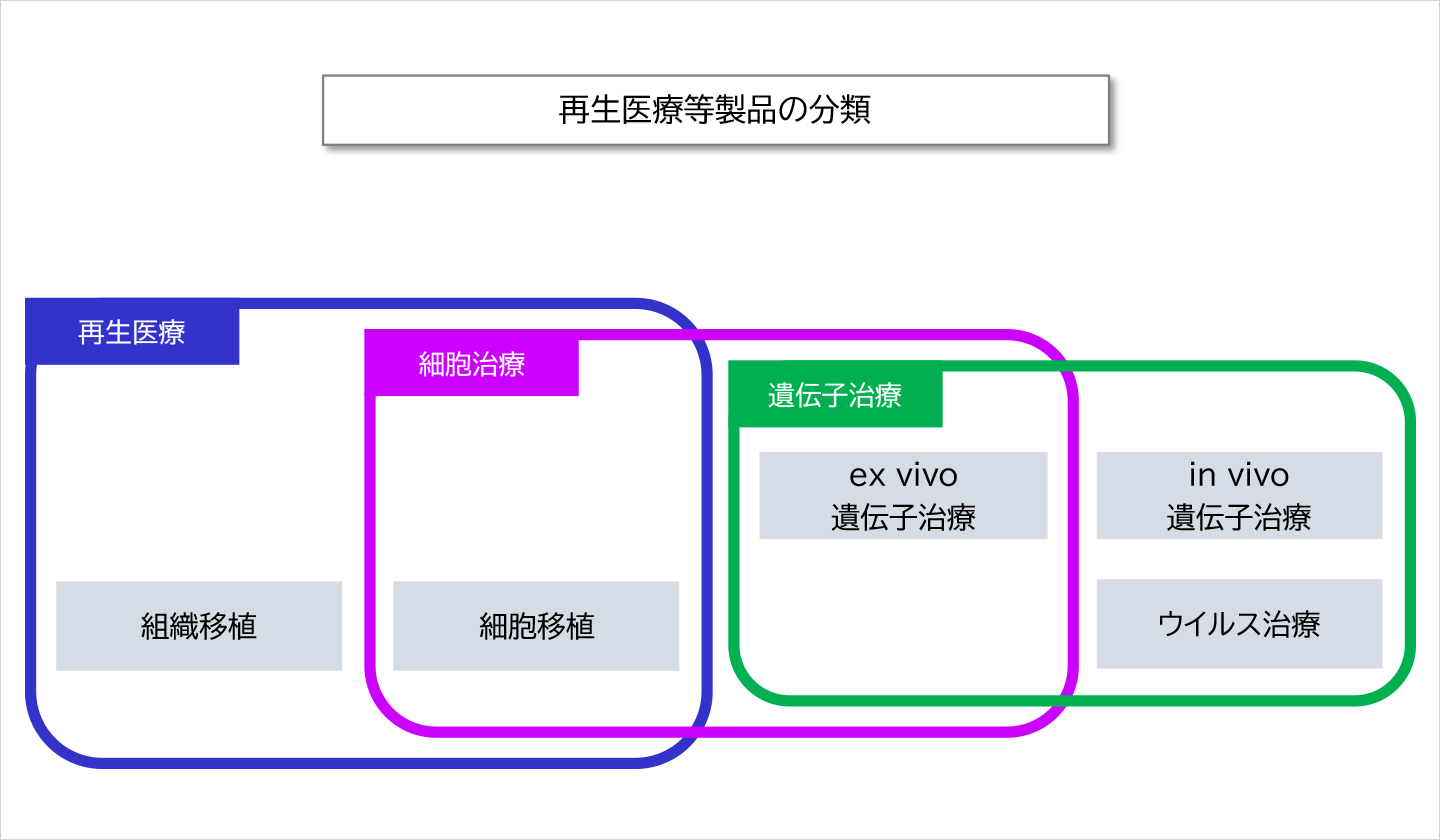
◇ 自家細胞と他家細胞
加工に使用する細胞として、患者自身の細胞を用いる方法と患者以外の細胞を用いる方法があります。患者自身から採取した細胞を用いる場合を「自家細胞」、患者以外から採取した細胞を用いる場合を「他家細胞」と言います。
自家細胞の場合、使用するのは自身の細胞なので、移植で問題になる免疫型不適合による拒絶反応は起きませんが、特注品なので費用と時間がかかります。
◇ 細胞の分化と幹細胞
生体は元をたどれば、受精卵という一つの細胞です。これが分裂を繰り返しながら、一定の機能や形を持つ細胞に変化していきます。この変化を「分化」と言います。
細胞は未分化の状態から段階的に分化して身体の一部を構成する細胞になります。普通の細胞はいったん分化を終えると、改めて他の細胞に分化することはできません。
細胞のなかには幹細胞と呼ばれるものがあります。これは分化途中あるいは分化前の状態で他の細胞に分化することができるのですが、多分化能(複数の種類の細胞を作り出す能力)と自己複製能(多分化能を保持したまま増殖できる能力)を持っています。
では実際にどういうものがあるでしょうか。いくつかの製品例とともに見てみましょう。
1)再生医療 <組織移植>
細胞を構造化し、外科手術により患部に移植することで、身体の構造・機能の再建・修復・形成を実現する治療です。
外傷性軟骨欠損症に移植する軟骨組織や、心不全の治療として心臓に貼付することで心筋の機能を改善させる心筋シート等があります。
2)再生医療・細胞治療 <細胞移植>
細胞そのものを投与することにより、身体の構造・機能の再建・修復・形成を実現する治療です。
外傷性脊髄損傷の治療として神経細胞への分化能を持つ骨髄間葉系幹細胞を投与するといったものがあります。
3)細胞治療・遺伝子治療 <ex vivo遺伝子治療>
体外に取り出した細胞に遺伝子改変・導入を行い、培養して増やした細胞を投与することにより、疾病を治療するものです。
がんへの攻撃能を持つT細胞を採取し、攻撃能をアップさせる遺伝子導入を行って投与するという治療法があります。
4)遺伝子治療 <in vivo遺伝子治療>
遺伝子治療用製品(目的遺伝子を運搬体であるベクターに搭載したもの)を投与し、体内で遺伝子が発現することにより、疾病を治療するものです。ここで、ベクターというのは、細胞へ遺伝子を導入する際の運び屋で、ウイルスベクターやプラスミド等があります。
血管新生を促すタンパクのもとになる遺伝子を含むプラスミドを投与することで虚血状態を改善させる治療等があります。
5)遺伝子治療 <腫瘍溶解性ウイルス>
遺伝子組み換えウイルスの投与により、疾病を治療するものです。
がん細胞のみで増殖するウイルスによるがん治療の研究が進んでいます。2021年1月現在、国内で承認されたものはまだありませんが、承認申請中のものはあります。
研究開発~承認~製造販売後のプロセスは基本的には医薬品のプロセスと同様ですが、多くの場合、細胞由来であることや経験や知見の蓄積が乏しいといったことから、品質・安全性の確保には難しさがあります。
製造においては、再生医療等製品の製造を行う製造所の製造管理及び品質管理の基準としてGCTP(Good Cell/Tissue Practice)があります。これは医薬品におけるGMP(Good Manufacturing Practice)に相当します。
また安定した物質である医薬品とは取扱いが大きく異なりますので、物流面の特異性を考慮する必要があります。
製造販売承認制度は基本的には医薬品と同じです。異なるのは、条件付き承認制度です。
医薬品の場合、承認条件が付与されてそれに対応する内容が確認されれば条件は解除になります。つまり承認自体に期限はなく、改めての承認申請は不要です。
これに対して、再生医療等製品では、「条件および期限付き承認」となります。ある期間に限って条件付きで承認を与えるものですので、期限内に必要な情報を充足させて再度承認申請を行う必要があります。
再生医療等製品は、個人または少数の患者に特化して製造される製品です。
そのプロセスを患者自身の細胞(自家細胞)を用いる製品で見てみると、
医療機関で患者自身から細胞を採取
⇒医療機関から製造所へ細胞を輸送
⇒製造所で製品製造(細胞の培養など)
⇒製造所から医療機関へ製品を輸送
⇒医療機関で患者自身に投与
となります。
生きた組織・細胞等を用いるため、製造工程のコントロールが難しく、また安定性の面でも通常の医薬品とは異なりますので、製造、保存・保管、出荷・輸送において品質管理がより重要です。このことから、細胞等の採取・製造・輸送・投与プロセスにわたって、厳格な品質管理と検体の個体識別やスケジュール管理等を含む情報トレースが必要となります。
再生医療等製品は扱いの難しい面もありますが、従来の医薬品では治療の難しかった疾患に対して新たな治療法を提供するものとして期待されています。
私たちの健康に大きな役割を担う医薬品、そして医療・ヘルスケア。
そうしたQOL(Quality Of Life)産業界全般にわたって、そのプロセスや情報を支えるITを介して、日立医薬情報ソリューションズは人々の健康・QOL向上に貢献していきます。
2021年02月10日
吉田 亜登美